Relationship between photosynthetic compensation limitation and photoassimilates of maize under heterogeneous light
-
摘要:
在异质性光环境中, 植物通常会表现出光合补偿现象以增强对光能的利用。而有些植物的光合补偿会受到明显的限制, 但其中所涉及的生物学特征和机制并不清楚。本研究以光合补偿受限的玉米植株为材料, 对比分析了异质性光(HL)和同质性光(FL)下未遮光叶片的解剖结构、气体交换特征、光合同化物及关键合成酶含量, 探讨光合补偿限制相关的生物学过程及其机制。结果表明: 与FL相比, HL处理下叶片的厚度、相对叶肉细胞面积、相对维管束鞘细胞面积、相对维管束面积和维管束鞘与维管束接触长度较小。同时, HL处理下叶片的净光合速率和气孔导度较低。此外, HL处理下叶片的淀粉含量较低, 蔗糖含量变化不大, 而蔗糖磷酸合成酶含量较高。因此, HL处理下光合补偿受限与叶片解剖结构限制及气孔行为相关。光合补偿受限时, 未遮光叶片中光合产物合成减少, 但其会更多地向蔗糖合成方向分配。然而, 由于叶片解剖结构的限制, 叶片蔗糖的输出能力较弱。这些结果为进一步解析植物适应异质性光环境的特征和机制, 以及选育适合间套作等栽培模式的品种提供了基础。
Abstract:In natural and field environments, different parts of plants are exposed to various light conditions, such as heterogeneous light. Leaves exposed to more favorable light conditions typically improve the efficiency of plant light energy use by enhancing photosynthesis in heterogeneous light environments, a phenomenon known as the photosynthetic compensation response. Photosynthetic compensation in some plants is limited; however, the biological characteristics and mechanisms involved are unclear. In this study, maize plants with limited photosynthetic compensation were used in a pot experiment. A nylon mesh with a light transmittance of 25% was used to shade maize plants unilaterally and two treatments of homogeneous light (FL) and heterogeneous light (HL) were set up. We compared the anatomical structure, gas exchange characteristics, photosynthetic assimilates, and key synthase contents of unshaded leaves under HL and FL treatments. The results showed that leaf thickness, relative mesophyll cell area, relative bundle sheath cell area, relative bundle area, and vascular sheath-vascular bundle contact length of leaves under the HL treatment were smaller than those under the FL treatment. Meanwhile, the net photosynthetic rate and stomatal conductance of leaves under the HL treatment were lower. In addition, the starch content of the leaves in the HL treatment was lower, the sucrose content was slightly changed, and the sucrose phosphate synthetase content was higher. Therefore, the restriction of photosynthetic compensation under HL treatment is related to the limitation of leaf anatomical structure and stomatal behavior. When photosynthetic compensation was limited, the synthesis of photosynthetic products in the unshaded leaves decreased; though, more photosynthates were allocated to sucrose synthesis. However, owing to morphological and anatomical limitations, the output capacity of leaf sucrose was weak. These results provide a basis for further analyses of the characteristics and mechanisms of plant adaptation to heterogeneous light environments and for breeding varieties suitable for intercropping.
-
在自然或农田环境中, 同一植株的不同部位经历不同的光照条件[1-3], 导致光照在时间和空间上呈现不均一的分布, 即异质性光环境(heterogeneous light environment, HL)[4-5]。例如, 在大豆[Glycine max (L.) Merr.]-玉米(Zea mays L.)带状复合种植模式中, 玉米常以宽窄行方式进行栽种。宽行侧叶片处于较强光照下(无遮荫或者遮荫程度较轻), 而窄行侧叶片处于较弱光照下(植株相互遮荫程度较重), 使得植株两侧的光环境呈现明显的异质性[5]。研究发现, 处于较强光照下的叶片光合能力通常会增强, 以补偿同一株植物上处于较弱光照下的叶片光合能力的减弱, 这一现象被称为“补偿性光合作用”, 即光合补偿[4]。光合补偿被认为是植物充分利用光照资源的重要方式, 使植株能更好地适应异质性的光环境。然而, 有些植物材料中, 光合速率在处于较强光照下的叶片中并不会提高, 甚至会下降, 这表明存在光合补偿能力的限制。例如, 对一些高粱(Sorghum bicolor L.)[6]和大豆[7]的部分叶片进行遮光后, 未遮光叶片的光合速率会明显下降, 限制了光合补偿的效果。
植物的光合补偿可能参与了对光合同化物的系统调控[4]。在异质性光环境下, 光合同化物在植物不同部位的分布表现出明显的差异。以拟南芥[Arabidopsis thaliana (L.) Heynh.]为例, 当成熟叶被遮阴时, 遮光叶的光合同化物含量增加, 而未遮光叶的光合同化物含量降低[8]。然而, 在玉米[9]和大豆[10]的研究中发现未遮光叶的光合同化物含量并没有发生显著变化。在异质性光下, 这种光合同化物含量的变化与其在植物体内的输出密切相关[4,7-8]。通常情况下, 当植株部分叶片被遮光时, 叶片的光合能力减弱, 导致合成与输出的光合同化物较少; 但未遮光叶片的光合能力增强, 合成更多光合同化物并大量输出[4,11-12], 以满足植株的生长发育需求。然而, 当光合补偿受限时, 未遮光叶片的光合能力也会减弱, 难以合成并输出大量的光合同化物。因此, 这些植株对异质性光的适应能力往往较弱。
光合作用是玉米产量形成的基础。在大豆-玉米带状复合种植模式中, 玉米植株由于处在明显异质性光下, 需要具备较强的光合补偿能力才能保证高产稳产。然而, 有些玉米品种在带状复合种植模式中产量会大幅度下降, 相较于净作玉米减产率可达20%[13], 这与光合补偿能力受到较大限制有密切关系[10]。为明确玉米植株光合补偿限制相关的影响因素, 本研究以大豆-玉米带状复合种植模式为背景, 选择减产率较高的玉米品种为材料进行异质性光处理。与先前多数研究关注密植引起的垂直方向异质性光不同, 本研究是对植株单侧进行遮光, 在水平方向上设置异质性光。已有的研究表明, 在这样的异质性光下, 不同植株光合能力的差异主要表现在未遮光侧的叶片[14]。因此, 本研究通过对未遮光叶片的解剖结构、光合特征及光合同化物的检测, 分析光合补偿限制相关的生物学过程, 进一步解析其机制, 为选育适合间套作等栽培模式的品种提供依据。
1. 材料与方法
1.1 供试材料
供试玉米品种为‘中单808’, 株型半紧凑, 净作产量≥7500 kg·hm−2, 套作减产率20%左右[14]。
1.2 试验设计
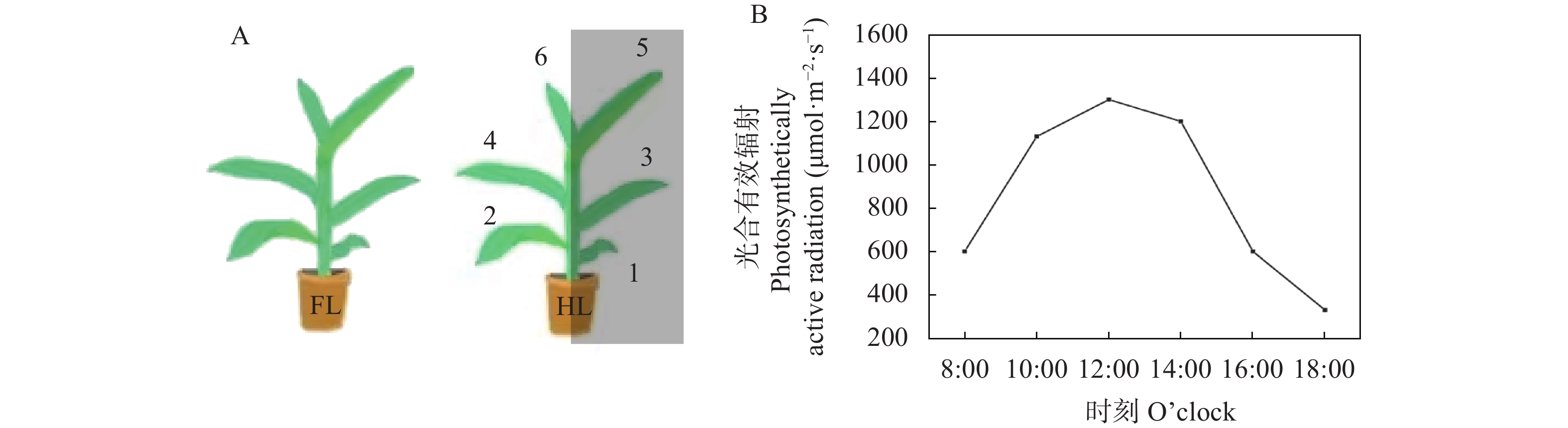
试验在四川农业大学成都校区进行。挑选籽粒饱满、大小均匀的玉米种子在育苗盘中培育。待玉米苗长至5 cm高时, 将其移植于铺满营养土、蛭石和珍珠岩(营养土∶蛭石∶珍珠岩=3∶1∶1)的圆形花盆(直径25 cm, 深度40 cm)中, 每个花盆移栽1株。植株置于自然光照下, 并确保每个植株的受光方向一致。在植株生长期间, 保证充足的水分与营养供应。共培养了3批材料, 每批材料超过8盆。
当植株生长至第6片叶可见时, 选取长势一致的植株随机分成两组(图1A): 一组继续置于自然光照下作为同质性光对照(FL); 另一组的植株使用透光率为25%的遮阳网对第1、3、5片叶一侧进行遮光处理, 另一侧置于自然光照下, 即异质光处理(HL)。待第6片叶完全展开(约10 d)后, 选取FL和HL处理的第6片叶叶片中段(避开主叶脉)进行检测。取样时间段为8:00—18:00, 每间隔2 h进行一次。检测时使用植物冠层分析仪测定环境中的光合有效辐射, 结果如图1B所示。
1.3 测定指标及方法
1.3.1 光合参数
使用便携式光合作用测定系统(LI-6400XT, 配备红蓝光源叶室6400-02B, Li-COR, 美国)在CO2浓度为400 µmol(CO2)∙mol−1和不同光照强度下测定净光合速率(Pn)和气孔导度(Gs), 其中光照强度的设置以环境光合有效辐射(图1B)为依据 。
1.3.2 叶片解剖结构
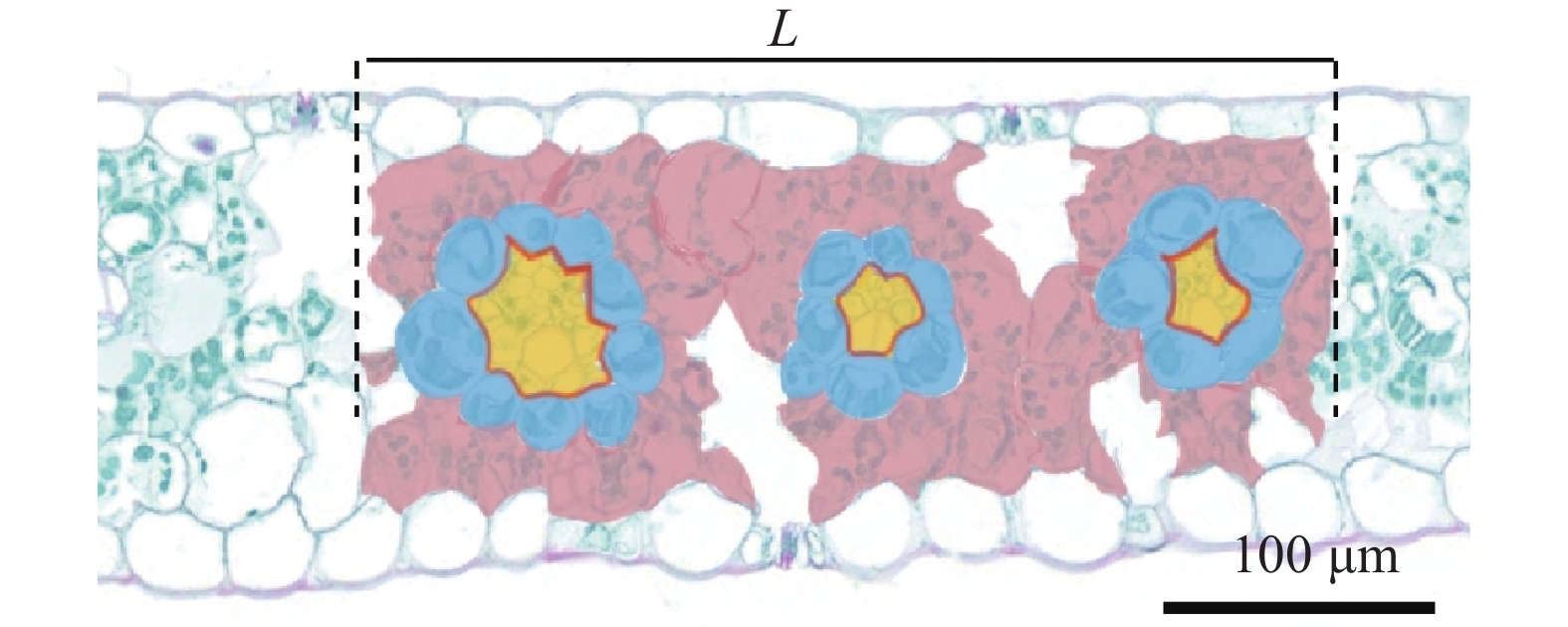
取叶片中段主脉两侧大约1 cm×1 cm左右的小块, 用标准固定液(FAA)固定。然后经酒精和正丁醇脱水, 再进行石蜡包埋。使用RM2016型切片机(Leica, 德国)切片后用松节油和酒精脱蜡, 复水后进行番红染色, 使用中性树胶封片。切片用Nikon eclipse50i型显微镜(Nikon, 日本)进行观察, 然后用ACT-2U成像系统拍摄照片。使用CaseViewer软件测量照片上的叶片厚度, 以及维管束鞘细胞与维管束等结构, 参照Huang等[4]的方法计算相对维管束鞘细胞面积(SBSC)、相对维管束面积(SVB)、维管束鞘与维管束接触面积(ILBSC-VB), 定义切片中多个维管束所在范围长度“L”内, 所有叶肉细胞的面积(图2中浅红色部分)与“L”的比值为SMC; “L”内所有维管束鞘细胞的面积(图2中蓝色部分)与“L”的比值为SBSC; “L”内所有维管束的面积(图2中黄色部分)与长度“L”的比值为SVB; “L”内所有维管束鞘细胞与维管束的接触线长度(图2中红线部分)与长度“L”的比值为ILBSC-VB。
1.3.3 蔗糖和淀粉含量的测定
取0.1 g玉米叶片用80%乙醇研磨至匀浆, 80℃水浴30 min, 冷却后1000 r∙min−1离心15 min。上清液用于测定蔗糖含量, 沉淀用于测定淀粉含量[15]。
蔗糖含量的测定根据Johnson等[16]的方法, 取上清液定容到100 mL, 待测。吸取0.9 mL待测液, 加入0.1 mL的2 mol∙L−1 NaOH, 95℃沸水浴10 min。冷却后加入1 mL的0.1 mol∙L−1间苯二酚和3 mL的10 mol∙L−1 HCl, 80℃水浴60 min, 冷却后使用酶标仪在500 nm处测定吸光度值。根据标准曲线计算蔗糖含量。
淀粉含量的测定根据Sun等[10]的方法, 沉淀在80℃烘箱中烘干, 冷却后加入2 mL蒸馏水, 95℃水浴20 min, 再加入2 mL 9 mol∙L−1 HClO4、2 mL 4.6 mol∙L−1 HClO4和6 mL蒸馏水, 离心, 上清液合并定容到100 mL作为淀粉待测液。在待测液中加入蒽酮试剂, 90℃水浴15 min。冷却后使用酶标仪在620 nm处测定吸光度值。根据标准曲线计算淀粉含量。
1.3.4 蔗糖磷酸合酶(SPS)和腺苷葡萄糖焦磷酸化酶(AGPase)含量的测定
使用PBS缓冲液将叶片匀浆[14], 匀浆在5000 r∙min−1离心10 min, 取上清液备用。SPS和AGPase含量的测定使用双抗体夹心法酶联免疫试剂盒(凡科维, 上海)进行。向抗体包被的微孔中加入备用上清液, 再加入HRP (辣根过氧化物酶)标记抗体, 形成抗体-抗原-酶标抗体复合物。然后加入TMB (3,3',5,5'-四甲基联苯胺)进行显色, 测定在450 nm波长下的吸光度值并依据标准曲线计算酶的含量。
1.4 数据分析
使用Excel 2019和SPSS 25.0软件进行数据统计和差异分析。同一处理在不同时间点的差异采用单因素分析法进行分析(P<0.05); 不同处理在同一时间点的差异采用T-检验进行分析。使用Origin 2021和Word 2019软件绘制图表。
2. 结果与分析
2.1 叶片解剖结构
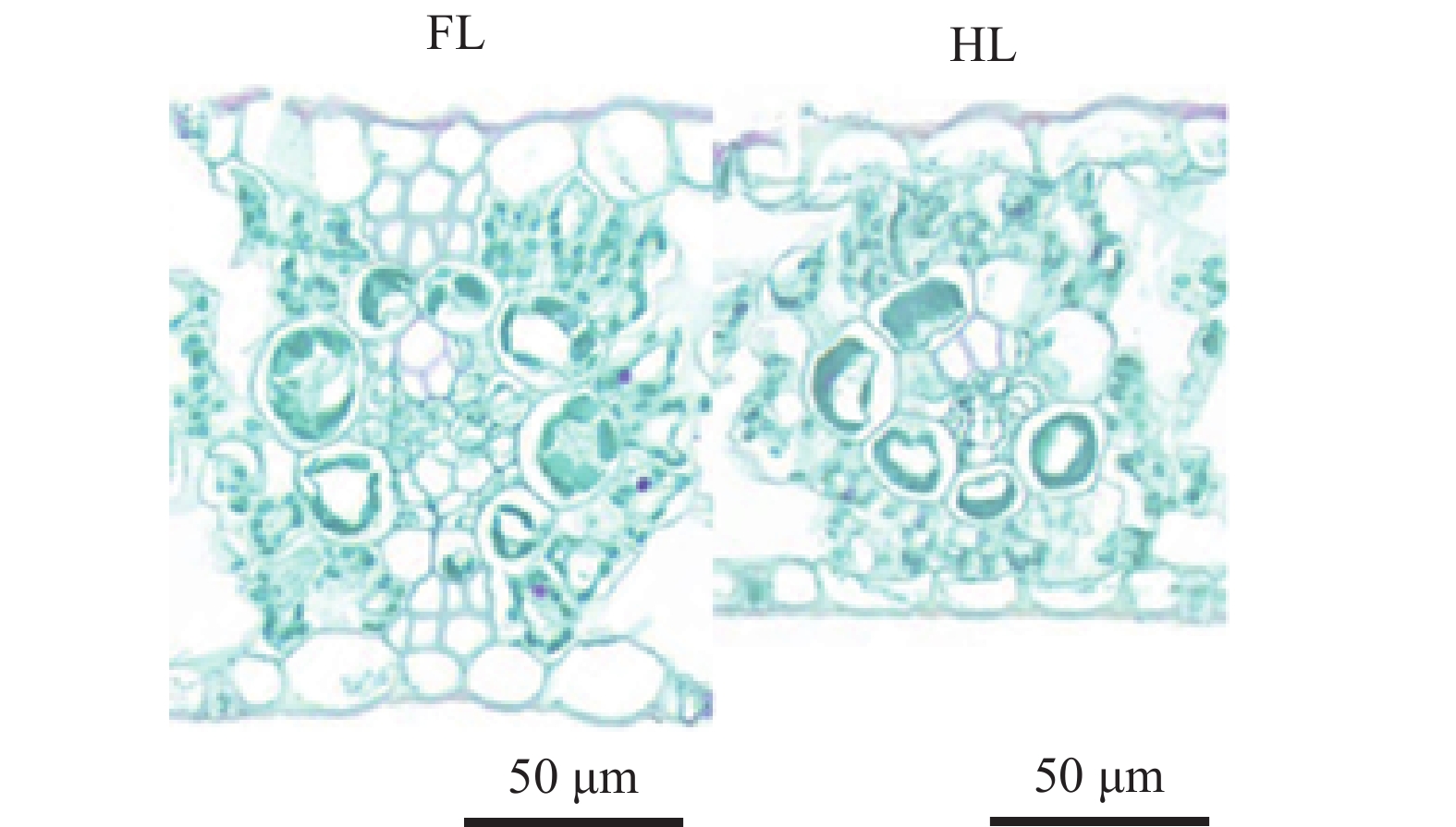
对玉米未遮光侧叶片解剖结构的检测结果表明, 与FL处理相比, HL处理下未遮光侧叶片厚度显著减少9.10% (图3, 表1), SMC显著减少14.00% (表1)。同时, SBSC和SVB分别显著减小4.17%和7.88% (表1)。在异质性光下, 未遮光侧叶片ILBSC-VB显著低于FL处理, 减少约5.10% (表1)。可见, 异质性光处理不仅减小了未遮光侧叶片厚度, 还减小了该叶片的SMC、SBSC、SVB和ILBSC-VB。
表 1 同质性光处理(FL)和异质性光处理(HL)下玉米叶片的解剖结构指标Table 1. Characteristics of leaf anatomical structure indexes under homogeneous light (FL) and heterogeneous light (HL) treatments处理
Treatment叶片厚度
Leaf thickness (μm)SMC
(μm2·μm−1)SBSC
(μm2·μm−1)SVB
(μm2·μm−1)ILBSC-VB
(μm·μm−1)FL 150.60±1.92 62.15±1.94 26.69±1.03 6.95±0.52 119.99±5.40 HL 136.90±3.66** 54.45±2.67*** 25.57±1.06*** 6.41±0.41*** 113.88±3.43* *、**和***分别表示不同处理间在P<0.05、P<0.01和P<0.001水平差异显著。SMC: 范围长度L内所有叶肉细胞面积与L的比值; SBSC: 范围长度L内所有维管束鞘细胞面积与L的比值; SVB: 范围长度L内所有维管束面积与L的比值; ILBSC-VB: 范围长度L内所有维管束鞘细胞与维管束的接触长度与L的比值。*, ** and *** represents significant difference between two treatments at P<0.05, P<0.01 and P<0.001 levels, respectively. SMC: the rate of area of all mesophyll cells within the length range L to L; SBSC: the rate of area of all bundle sheath cells within the length range L to L; SVB: the rate of area of all vascular bundles within the length range L to L; ILBSC-VB: the rate of total contact length between all bundle sheath cells and vascular bundles within the length range L to L. 2.2 叶片净光合速率(Pn)和气孔导度(Gs)
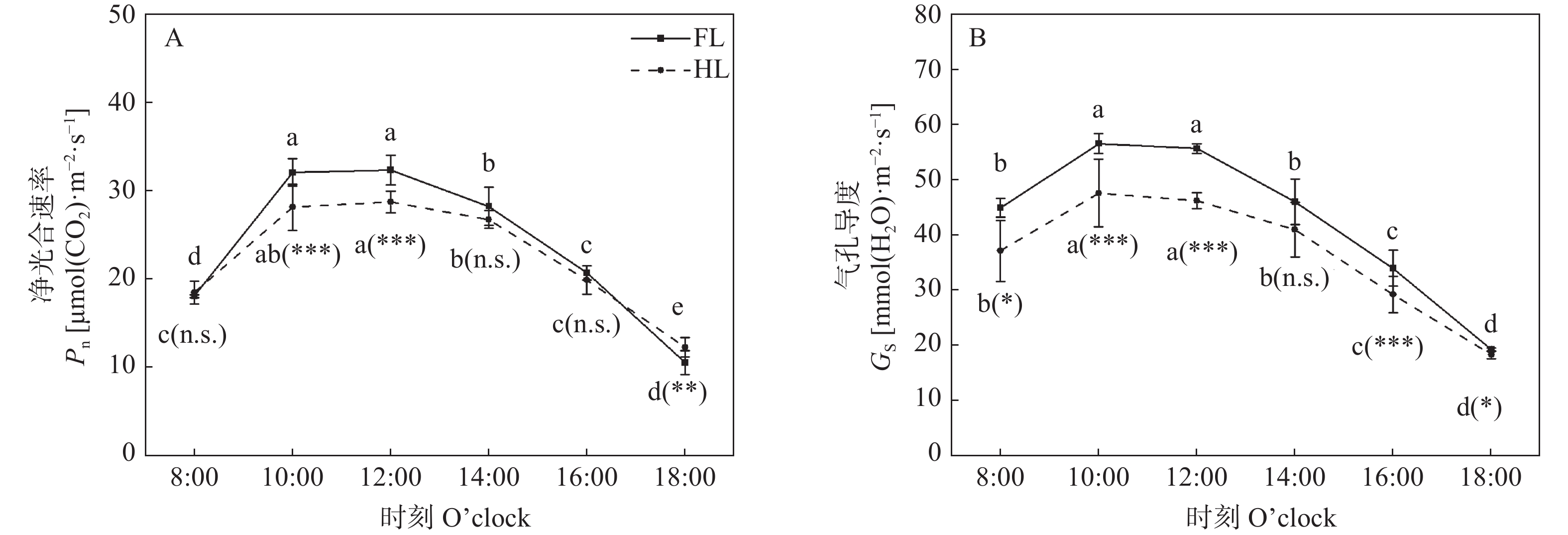
检测结果显示: FL和HL处理的叶片净光合速率(Pn)在一天之中均呈现单峰曲线的变化过程(图4A), 未出现“光合午休”现象, 与光合有效辐射的变化过程一致(图1B)。8:00时, FL和HL处理的Pn没有显著差异, 之后随着光照增强明显上升(图4A)。在一天之中光照最强的时段(10:00—14:00), Pn在HL处理中明显低于FL处理(图4A), 表现出光合补偿的限制。14:00之后, Pn在HL和FL处理中均持续下降且没有显著差异。然而, 在HL处理中, 未遮光侧叶片的Pn下降速度较缓, 16:00之后甚至高于FL处理(图4A)。
![]() 图 4 同质性光处理(FL)和异质性光处理(HL)下玉米叶片的净光合速率(A)和气孔导度(B)不同小写字母表示同一处理不同时间点在P<0.05水平差异显著; *、**和***表示同一时间点不同处理间在P<0.05、P<0.01和P<0.001水平差异显著, n.s.表示同一时间点不同处理间差异不显著。Different lowercase letters denote significant differences among different time points of the same treatment at P<0.05 level. *, ** and *** represent significant differences between two treatments at the same time point at P<0.05, P<0.01 and P<0.001 levels, respectively; and n.s. represents no significant difference between two treatments at the same time point.Figure 4. Leaf net photosynthetic rate (Pn, A) and stomatal conductance (Gs, B) of maize under homogeneous light (FL) and heterogeneous light (HL) treatments
图 4 同质性光处理(FL)和异质性光处理(HL)下玉米叶片的净光合速率(A)和气孔导度(B)不同小写字母表示同一处理不同时间点在P<0.05水平差异显著; *、**和***表示同一时间点不同处理间在P<0.05、P<0.01和P<0.001水平差异显著, n.s.表示同一时间点不同处理间差异不显著。Different lowercase letters denote significant differences among different time points of the same treatment at P<0.05 level. *, ** and *** represent significant differences between two treatments at the same time point at P<0.05, P<0.01 and P<0.001 levels, respectively; and n.s. represents no significant difference between two treatments at the same time point.Figure 4. Leaf net photosynthetic rate (Pn, A) and stomatal conductance (Gs, B) of maize under homogeneous light (FL) and heterogeneous light (HL) treatmentsFL和HL处理的未遮光侧叶片的气孔导度(Gs)在一天之中也呈单峰曲线的变化过程(图4B)。另外, 与FL处理相比, Gs在HL处理下较低, 14:00之前的差异较大, 为15.89%~17.45%; 14:00之后的差异较小, 为4.85%~14.12% (图4B)。可见, 异质性光下未遮光侧叶片的Gs减小, 说明从外界吸收的CO2减少, 从而引起Pn降低。
2.3 叶片光合同化物含量
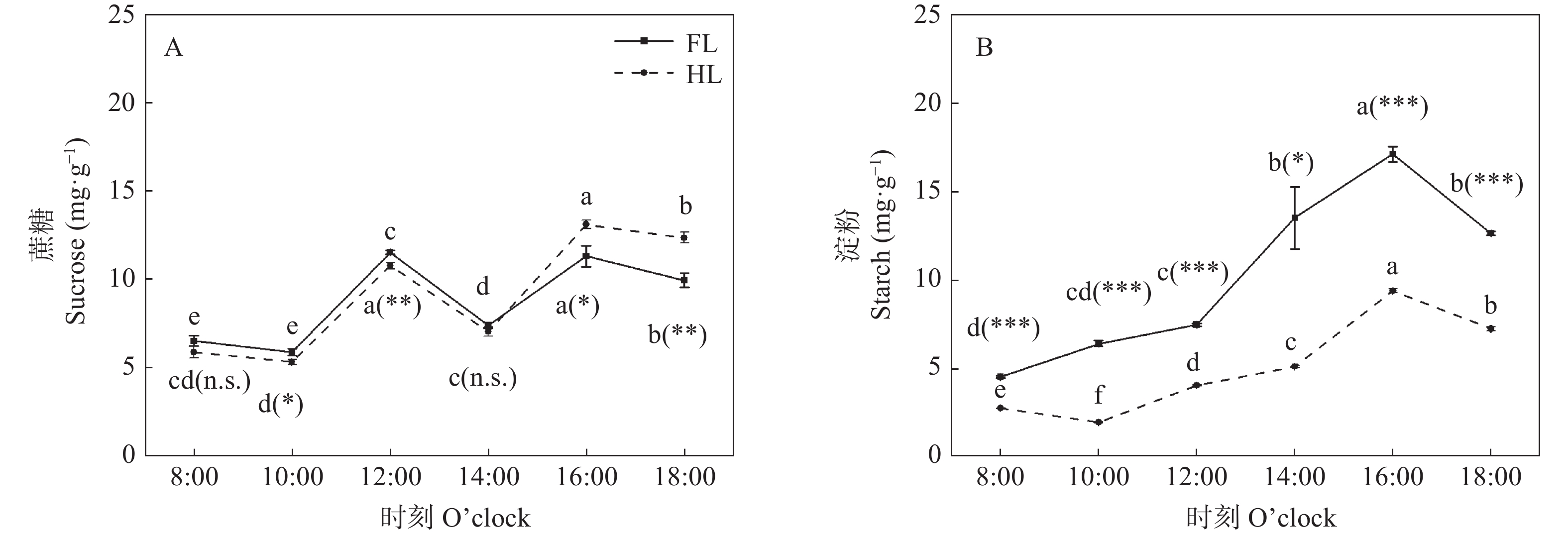
对叶片中蔗糖的检测结果显示: 在8:00—18:00, FL和HL处理中的蔗糖含量均呈现波动变化的趋势(图5A)。在8:00—14:00, 蔗糖含量在FL下略高于HL处理, 差异范围仅为4.82%~9.68%。而在16:00和18:00, HL处理的叶片蔗糖含量显著高于FL处理, 分别提高15.90%和24.28% (图5A), 可能是由于蔗糖积累导致了叶部蔗糖含量的增加。
![]() 图 5 同质性光处理(FL)和异质性光处理(HL)下玉米叶片蔗糖(A)和淀粉(B)的含量不同小写字母表示同一处理不同时间点在P<0.05水平差异显著; *、**和***分别表示同一时间点不同处理间在P<0.05、P<0.01和P<0.001水平差异显著, n.s.表示同一时间点不同处理间差异不显著。Different lowercase letters denote significant differences among different time points of the same treatment at P<0.05 level. *, ** and *** represent significant differences between two treatments at the same time point at P<0.05, P<0.01 and P<0.001 levels, respectively; and n.s. represents no significant difference between two treatments at the same time point.Figure 5. Contents of sucrose (A) and starch (B) of maize leaves under homogeneous light (FL) and heterogeneous light (HL) treatments
图 5 同质性光处理(FL)和异质性光处理(HL)下玉米叶片蔗糖(A)和淀粉(B)的含量不同小写字母表示同一处理不同时间点在P<0.05水平差异显著; *、**和***分别表示同一时间点不同处理间在P<0.05、P<0.01和P<0.001水平差异显著, n.s.表示同一时间点不同处理间差异不显著。Different lowercase letters denote significant differences among different time points of the same treatment at P<0.05 level. *, ** and *** represent significant differences between two treatments at the same time point at P<0.05, P<0.01 and P<0.001 levels, respectively; and n.s. represents no significant difference between two treatments at the same time point.Figure 5. Contents of sucrose (A) and starch (B) of maize leaves under homogeneous light (FL) and heterogeneous light (HL) treatments对叶片中淀粉的检测结果显示: 8:00之后, FL处理的叶片淀粉含量逐渐上升, 直至16:00达最高值, 随后开始下降。而在HL处理下, 叶片淀粉含量在8:00之后有所下降, 但在10:00之后逐渐上升, 与FL处理下的情况相似, 至16:00达最高值, 随后也开始下降。此外, 在8:00—18:00期间, HL处理的叶片淀粉含量显著低于FL处理, 差异范围为39.84%~70.27% (图5B)。由此可见, 异质性光环境下, 未遮光叶片合成的光合同化物减少, 从而导致叶片淀粉含量的减少。
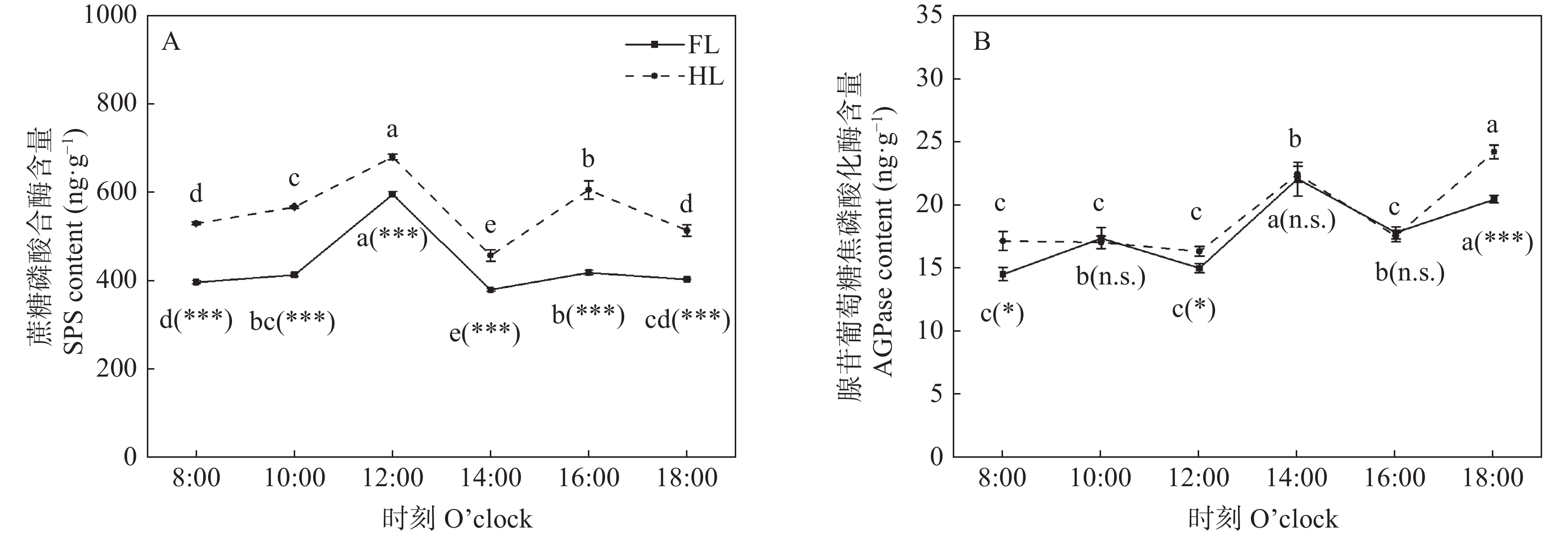
2.4 叶片蔗糖磷酸合酶(SPS)含量和腺苷葡萄糖焦磷酸化酶(AGPase)含量
对叶片中SPS的检测结果显示: 在8:00—18:00, HL处理的未遮光侧叶片SPS含量均显著高于FL处理(图6A), 其差异范围为14.40%~44.41%。在FL和HL处理下, SPS含量都在12:00达到最高(图6A)。在HL处理下, SPS含量在16:00再次大幅度上升, 但在FL处理中其上升幅度较为平缓(图6A)。由此可见, 异质性光处理增加了叶片的SPS含量, 促进了蔗糖的合成。
![]() 图 6 同质性光处理(FL)和异质性光处理(HL)下玉米叶片蔗糖磷酸合酶(A)和腺苷葡萄糖焦磷酸化酶(B)含量不同小写字母表示同一处理不同时间点在P<0.05水平差异显著; * 和***分别表示同一时间点不同处理间在P<0.05和P<0.001水平差异显著, n.s.表示同一时间点不同处理差异不显著。Different lowercase letters denote significant differences among different time points of the same treatment at P<0.05 level. * and *** represent significant differences between two treatments at the same time point at P<0.05 and P<0.001 levels, respectively; and n.s. represents no significant difference between two treatments at the same time point.Figure 6. Contents of sucrose phoshpate synthase (SPS, A) and adenosine glucose pyrophosphorylase (AGPase, B) of maize leaves under homogeneous light (FL) and heterogeneous light (HL) treatments
图 6 同质性光处理(FL)和异质性光处理(HL)下玉米叶片蔗糖磷酸合酶(A)和腺苷葡萄糖焦磷酸化酶(B)含量不同小写字母表示同一处理不同时间点在P<0.05水平差异显著; * 和***分别表示同一时间点不同处理间在P<0.05和P<0.001水平差异显著, n.s.表示同一时间点不同处理差异不显著。Different lowercase letters denote significant differences among different time points of the same treatment at P<0.05 level. * and *** represent significant differences between two treatments at the same time point at P<0.05 and P<0.001 levels, respectively; and n.s. represents no significant difference between two treatments at the same time point.Figure 6. Contents of sucrose phoshpate synthase (SPS, A) and adenosine glucose pyrophosphorylase (AGPase, B) of maize leaves under homogeneous light (FL) and heterogeneous light (HL) treatments对叶片中AGPase的检测结果显示: 在FL和HL处理中, AGPase含量在8:00—18:00均呈现波动变化的趋势(图6B)。8:00、12:00及18:00, HL处理下AGPase含量分别比FL处理显著提高18.07%、8.84%和18.30%, 其余时刻无显著差异(图6B)。因此, 异质性光处理对叶片AGPase含量没有明显的影响, 维持了与同质光处理下叶片相当水平的淀粉合成。
3. 讨论
光合补偿是植株个体在异质性光环境中的响应方式, 被认为是植物充分利用光照资源的重要途径[4]。然而, 一些研究发现植物在异质性光环境中的光合补偿会受到限制[3,6-7]。本研究发现, 在HL处理中, 玉米未遮光叶片的Pn在光照最强的时段显著低于FL处理(图4A), 呈现明显的光合补偿受限现象。在异质性光环境中, 植物叶片的光合能力与气孔导度密切相关[17-18]。崔月等[19]的研究表明, 不同类型的玉米叶片Gs与Pn呈显著正相关。较高的Gs可以增强叶片对CO2的吸收能力, 有利于光合能力的提高; 而较低的Gs会限制叶片对CO2的摄入, 从而降低光合能力[7,18,20]。本研究发现, 在HL处理中未遮光叶片的Gs显著低于FL处理, 特别是在光照最强的时段(图4B)。一天中Gs的变化趋势与Pn基本一致, 都呈单峰曲线(图4)。基于这些结果, 可以推测Gs是影响光合补偿的重要因素。此外, 玉米作为典型的C4植物, 其光合作用由叶肉细胞和维管束鞘细胞共同完成。本研究发现, 在HL处理中, 玉米未遮光叶片的厚度显著低于FL处理(图3), 且SMC和SBSC也低于FL处理(表1), 光合细胞体积较小, 这也是Pn在HL处理中低于FL处理的重要原因之一。这一结果与Jiang等[6]对高粱的研究结果一致。此外, 对大豆和菜豆(Phaseolus vulgaris L.)等C3植物的研究也发现, 异质性光下未遮光叶片的叶片厚度减小, 叶肉细胞减少会限制植株的光合补偿能力[7,21]。综上, 在异质性光环境下, 由于气孔和叶片解剖结构的限制, 未遮光叶片的Pn较低, 使玉米呈现光合补偿限制。
研究表明, 异质性光环境下光合补偿会影响叶片光合同化物的合成和运输[14,22]。本研究发现, 在HL处理中, 未遮光叶片的Pn较低(图4A), 光合产物的合成减少。在未遮光叶片中, 作为输出光合同化物的主要形式, HL处理中蔗糖的含量在8:00—14:00略低于FL处理; 与此同时, 作为光合同化物的主要贮藏形式, 淀粉含量在HL处理中显著低于FL处理(图5B)。此外, 在HL处理下, 蔗糖合成关键酶(SPS)的含量显著高于FL处理; 而淀粉合成关键酶(AGPase)的含量在HL和FL处理中差异较小(图6)。根据这些结果可推测, HL处理中未遮光叶片在Pn下降的情况下, 会减少光合产物向淀粉合成的分配以维持蔗糖合成, 从而满足光合同化物输出的需求。值得注意的是, 叶片内合成的蔗糖大部分输出光合细胞, 并经韧皮部装载途径进行长距离运输。而蔗糖的韧皮部装载受到了蔗糖转运相关的酶和基因的控制[23-24]。例如, 光合补偿强的叶片合成蔗糖多, 蔗糖转运蛋白(SUTs)和H+-ATPase含量高, 韧皮部装载能力增强, 蔗糖输出受到促进; 光合补偿弱的叶片合成蔗糖减少, SUTs和H+-ATPase含量低, 韧皮部装载能力减弱, 蔗糖输出受到抑制[25]。在本研究中, 未遮光侧叶片的光合补偿能力减弱, 蔗糖含量减少, 因此推测未遮光侧叶片内SUTs含量较低, 抑制蔗糖输出。此外, 玉米叶片结构具有典型的“花环结构”特征, 由维管束鞘细胞和叶肉细胞围绕叶脉同轴排列[26]。因此维管束鞘的结构特征应该被视为衡量异质性光下未遮光叶片光合同化物输出的重要指标之一[27]。本研究对叶片解剖结构的分析发现, 未遮光叶片的ILBSC-VB和SVB在HL处理中显著低于FL处理(表1)。表明光合同化物的装载和运输在HL处理中受到了限制。尽管蔗糖合成在一定程度上得以维持, 但蔗糖输出减少进一步限制了光合补偿能力。16:00以后, HL处理的叶片蔗糖含量显著高于FL处理, 进一步印证了蔗糖输出受阻, 叶片蔗糖含量在逐渐积累。综上, 在异质性光环境下, 未遮光叶片的光合同化产物更倾向于向蔗糖合成分配, 但是由于维管束的限制, 叶片中蔗糖输出受阻, 蔗糖逐渐积累。然而, 过量积累蔗糖可能对光合过程产生抑制, 进一步削弱了光合补偿能力[28-29]。
4. 结论
在异质性光环境下, 玉米未遮光叶片的叶片厚度、相对维管束鞘面积和气孔导度相对较小, 这些因素共同使得玉米叶片的净光合速率降低。因此, 玉米植株的光合补偿能力受到限制。当光合能力较弱、光合产物合成较少时, 未遮光叶片的光合产物会向蔗糖合成方向分配, 减少淀粉的合成。然而, 由于相对维管束面积和维管束鞘与维管束接触长度较小, 蔗糖的输出受限, 导致蔗糖在叶片内逐渐积累, 这可能进一步削弱了光合补偿。这些结果为进一步解析植物适应异质性光环境的特征和机制, 以及选育适合间套作等栽培模式的品种提供了理论基础。
-
图 4 同质性光处理(FL)和异质性光处理(HL)下玉米叶片的净光合速率(A)和气孔导度(B)
不同小写字母表示同一处理不同时间点在P<0.05水平差异显著; *、**和***表示同一时间点不同处理间在P<0.05、P<0.01和P<0.001水平差异显著, n.s.表示同一时间点不同处理间差异不显著。Different lowercase letters denote significant differences among different time points of the same treatment at P<0.05 level. *, ** and *** represent significant differences between two treatments at the same time point at P<0.05, P<0.01 and P<0.001 levels, respectively; and n.s. represents no significant difference between two treatments at the same time point.
Figure 4. Leaf net photosynthetic rate (Pn, A) and stomatal conductance (Gs, B) of maize under homogeneous light (FL) and heterogeneous light (HL) treatments
图 5 同质性光处理(FL)和异质性光处理(HL)下玉米叶片蔗糖(A)和淀粉(B)的含量
不同小写字母表示同一处理不同时间点在P<0.05水平差异显著; *、**和***分别表示同一时间点不同处理间在P<0.05、P<0.01和P<0.001水平差异显著, n.s.表示同一时间点不同处理间差异不显著。Different lowercase letters denote significant differences among different time points of the same treatment at P<0.05 level. *, ** and *** represent significant differences between two treatments at the same time point at P<0.05, P<0.01 and P<0.001 levels, respectively; and n.s. represents no significant difference between two treatments at the same time point.
Figure 5. Contents of sucrose (A) and starch (B) of maize leaves under homogeneous light (FL) and heterogeneous light (HL) treatments
图 6 同质性光处理(FL)和异质性光处理(HL)下玉米叶片蔗糖磷酸合酶(A)和腺苷葡萄糖焦磷酸化酶(B)含量
不同小写字母表示同一处理不同时间点在P<0.05水平差异显著; * 和***分别表示同一时间点不同处理间在P<0.05和P<0.001水平差异显著, n.s.表示同一时间点不同处理差异不显著。Different lowercase letters denote significant differences among different time points of the same treatment at P<0.05 level. * and *** represent significant differences between two treatments at the same time point at P<0.05 and P<0.001 levels, respectively; and n.s. represents no significant difference between two treatments at the same time point.
Figure 6. Contents of sucrose phoshpate synthase (SPS, A) and adenosine glucose pyrophosphorylase (AGPase, B) of maize leaves under homogeneous light (FL) and heterogeneous light (HL) treatments
表 1 同质性光处理(FL)和异质性光处理(HL)下玉米叶片的解剖结构指标
Table 1 Characteristics of leaf anatomical structure indexes under homogeneous light (FL) and heterogeneous light (HL) treatments
处理
Treatment叶片厚度
Leaf thickness (μm)SMC
(μm2·μm−1)SBSC
(μm2·μm−1)SVB
(μm2·μm−1)ILBSC-VB
(μm·μm−1)FL 150.60±1.92 62.15±1.94 26.69±1.03 6.95±0.52 119.99±5.40 HL 136.90±3.66** 54.45±2.67*** 25.57±1.06*** 6.41±0.41*** 113.88±3.43* *、**和***分别表示不同处理间在P<0.05、P<0.01和P<0.001水平差异显著。SMC: 范围长度L内所有叶肉细胞面积与L的比值; SBSC: 范围长度L内所有维管束鞘细胞面积与L的比值; SVB: 范围长度L内所有维管束面积与L的比值; ILBSC-VB: 范围长度L内所有维管束鞘细胞与维管束的接触长度与L的比值。*, ** and *** represents significant difference between two treatments at P<0.05, P<0.01 and P<0.001 levels, respectively. SMC: the rate of area of all mesophyll cells within the length range L to L; SBSC: the rate of area of all bundle sheath cells within the length range L to L; SVB: the rate of area of all vascular bundles within the length range L to L; ILBSC-VB: the rate of total contact length between all bundle sheath cells and vascular bundles within the length range L to L. -
[1] CHAZDON R L, WILLIAMS K, FIELD C B. Interactions between crown structure and light environment in five rain forest Piper species[J]. American Journal of Botany, 1988, 75(10): 1459 doi: 10.1002/j.1537-2197.1988.tb11220.x
[2] KAWAMURA K. A conceptual framework for the study of modular responses to local environmental heterogeneity within the plant crown and a review of related concepts[J]. Ecological Research, 2010, 25(4): 733−744 doi: 10.1007/s11284-009-0688-0
[3] LI T, LIU Y J, SHI L, et al. Systemic regulation of photosynthetic function in field-grown sorghum[J]. Plant Physiology and Biochemistry, 2015, 94: 86−94 doi: 10.1016/j.plaphy.2015.05.008
[4] HUANG S R, DU J B, WANG X C, et al. Involvement of carbohydrates in long-term light-dependent systemic regulation on photosynthesis of maize under light heterogeneity[J]. Plant Signaling & Behavior, 2019, 14(8): 1629266
[5] 朱启林, 向蕊, 汤利, 等. 间作对氮调控玉米光合速率和光合氮利用效率的影响[J]. 植物生态学报, 2018, 42(6): 672−680 doi: 10.17521/cjpe.2018.0033 ZHU Q L, XIANG R, TANG L, et al. Effects of intercropping on photosynthetic rate and net photosynthetic nitrogen use efficiency of maize under nitrogen addition[J]. Chinese Journal of Plant Ecology, 2018, 42(6): 672−680 doi: 10.17521/cjpe.2018.0033
[6] JIANG C D, WANG X, GAO H Y, et al. Systemic regulation of leaf anatomical structure, photosynthetic performance, and high-light tolerance in Sorghum[J]. Plant Physiology, 2011, 155(3): 1416−1424 doi: 10.1104/pp.111.172213
[7] WU Y S, GONG W Z, WANG Y M, et al. Leaf area and photosynthesis of newly emerged trifoliolate leaves are regulated by mature leaves in soybean[J]. Journal of Plant Research, 2018, 131(4): 671−680 doi: 10.1007/s10265-018-1027-8
[8] COUPE S A, PALMER B G, LAKE J A, et al. Systemic signalling of environmental cues in Arabidopsis leaves[J]. Journal of Experimental Botany, 2006, 57(2): 329−341 doi: 10.1093/jxb/erj033
[9] CHEN G P, CHEN H, SHI K, et al. Heterogeneous light conditions reduce the assimilate translocation towards maize ears[J]. Plants, 2020, 9(8): 987 doi: 10.3390/plants9080987
[10] SUN X, LU J, YANG M Y, et al. Light-induced systemic signalling down-regulates photosynthetic performance of soybean leaves with different directional effects[J]. Plant Biology, 2019, 21(5): 891−898 doi: 10.1111/plb.12980
[11] 黄思榕. 植株两侧光异质性条件下玉米叶片的形态结构和光合特性[D]. 成都: 四川农业大学, 2020: 32−33 HUANG S R. Leaf morphological structure and photosynthetic characteristics of maize plants in the condition of light heterogeneity on different sides[D]. Chengdu: Sichuan Agricultural University, 2020: 32−33
[12] HUANG S R, AI Y, DU J B, et al. Photosynthetic compensation of maize in heterogeneous light is impaired by restricted photosynthate export[J]. Plant Physiology and Biochemistry, 2022, 192: 50−56 doi: 10.1016/j.plaphy.2022.09.026
[13] 蒲甜. 套作高光效玉米品种的筛选和评价体系的初步建立[D]. 成都: 四川农业大学, 2016: 25−28 PU T. Preliminary establishment of screening and evaluation system for intercropping maize varieties with high light efficiency[D]. Chengdu: Sichuan Agricultural University, 2016: 25−28
[14] 邱茜. 光合产物的输出与积累对异质性光下玉米光合补偿影响的研究[D]. 成都: 四川农业大学, 2023: 12−34 QIU X. Effects of output and accumulation of photosynthetic products on photosynthetic compensation of maize under heterogeneous light[D]. Chengdu: Sichuan Agricultural University, 2023: 12−34
[15] 谷闻东, 刘春娟, 李邦, 等. 外源色氨酸对低氮胁迫下高粱苗期叶片碳氮平衡和衰老特性的影响[J]. 中国农业科学, 2023, 56(7): 1295−1310 GU W D, LIU C J, LI B, et al. Effects of exogenous tryptophan on carbon and nitrogen balance and aging characteristics of sorghum leaves at seedling stage under low nitrogen stress[J]. Scientia Agricultura Sinica, 2023, 56(7): 1295−1310
[16] JOHNSON G, LAMBERT C, JOHNSON D K, et al. Plant tissue analysis, colorimetric determination of glucose, fructose, and sucrose in plant materials using a combination of enzymatic and chemical methods[J]. Journal of Agricultural and Food Chemistry, 1964, 12(3): 216−219 doi: 10.1021/jf60133a007
[17] DONG T F, LI J Y, ZHANG Y B, et al. Partial shading of lateral branches affects growth, and foliage nitrogen- and water-use efficiencies in the conifer Cunninghamia lanceolata growing in a warm monsoon climate[J]. Tree Physiology, 2015, 35(6): 632−643 doi: 10.1093/treephys/tpv036
[18] NASAR J, KHAN W, KHAN M Z, et al. Photosynthetic activities and photosynthetic nitrogen use efficiency of maize crop under different planting patterns and nitrogen fertilization[J]. Journal of Soil Science and Plant Nutrition, 2021, 21(3): 2274−2284 doi: 10.1007/s42729-021-00520-1
[19] 崔月, 辛贵东, 李文, 等. 不同类型玉米光合特性日变化的比较研究[J]. 吉林农业大学学报, 2011, 33(3): 243−247 CUI Y, XIN G D, LI W, et al. Comparative study on diurnal variation of photosynthetic characters of different types of maize[J]. Journal of Jilin Agricultural University, 2011, 33(3): 243−247
[20] 常琛颉, 钟波, 李伸, 等. 黄蜀葵光合特性研究[J]. 现代农业科技, 2023(16): 61−63 CHANG C J, ZHONG B, LI S, et al. Photosynthetic characteristics of Abelmoschus manihot (L.) Medicus[J]. Modern Agricultural Science and Technology, 2023(16): 61−63
[21] MURAKAMI K, MATSUDA R, FUJIWARA K. Light-induced systemic regulation of photosynthesis in primary and trifoliate leaves of Phaseolus vulgaris: effects of photosynthetic photon flux density (PPFD) versus spectrum[J]. Plant Biology, 2014, 16(1): 16−21 doi: 10.1111/plb.12055
[22] RUAN Y L, JIN Y, YANG Y J, et al. Sugar input, metabolism, and signaling mediated by invertase: roles in development, yield potential, and response to drought and heat[J]. Molecular Plant, 2010, 3(6): 942−955 doi: 10.1093/mp/ssq044
[23] AMIARD V, MUEH K E, DEMMIG-ADAMS B, et al. Anatomical and photosynthetic acclimation to the light environment in species with differing mechanisms of phloem loading[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(36): 12968−12973
[24] SLEWINSKI T L, BRAUN D M. Current perspectives on the regulation of whole-plant carbohydrate partitioning[J]. Plant Science, 2010, 178(4): 341−349 doi: 10.1016/j.plantsci.2010.01.010
[25] 艾媛. 异质性光下玉米叶片光合补偿与光合产物输出的研究[D]. 成都: 四川农业大学, 2021: 31−32 AI Y. Study on photosynthetic compensation and photosynthetic product output of maize leaves under heterogeneous light[D]. Chengdu: Sichuan Agricultural University, 2021: 31−32
[26] 许大全, 朱新广. 创造“玉米稻”: 禾谷作物高产优质的一个新战略[J]. 植物生理学报, 2020, 56(7): 1313−1320 XU D Q, ZHU X G. Creating “maize and rice”: a new strategy for high yield and quality cereal crops[J]. Plant Physiology Journal, 2020, 56(7): 1313−1320
[27] 杜康兮, 江青山, 徐培洲, 等. 水稻籽粒灌浆突变体gef1的鉴定及其基因定位[J]. 科学通报, 2016, 61(25): 2800−2810 doi: 10.1360/N972015-01412 DU K X, JIANG Q S, XU P Z, et al. Identification and gene mapping of rice grain filling mutant gef1[J]. Chinese Science Bulletin, 2016, 61(25): 2800−2810 doi: 10.1360/N972015-01412
[28] PROVENCHER L M, MIAO L, SINHA N, et al. Sucrose export defective1 encodes a novel protein implicated in chloroplast-to-nucleus signaling[J]. The Plant Cell, 2001, 13(5): 1127−1141 doi: 10.1105/tpc.13.5.1127
[29] WANG L H, ZHAI Y N, WU J X, et al. Low night temperature-induced feedback inhibition of photosynthesis through sucrose accumulation in sugar beet (Beta vulgaris L.) leaves[J]. Environmental and Experimental Botany, 2022, 204: 105083 doi: 10.1016/j.envexpbot.2022.105083
-
期刊类型引用(1)
1. 周苗苗,何瑞通,李兰,王红鑫,彭浩源,张玉博,张丹,王进斌,罗新宁,祁炳琴. 高密度种植下生长调节剂“玉黄金”对玉米光合特性及产量形成的影响. 作物杂志. 2025(01): 162-169 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: